Продукты
Формулировка
Натриевые соли EDTA EDTA.2Na
Натриевые соли EDTA, хорошо известные в промышленности моющих средств, сельского хозяйства, пищевой и нефтехимической промышленности. В данной статье, после химического анализа структуры ЭДТА, подробно рассматриваются его физико-химические свойства, а также различные применения. В заключение будет предоставлена краткая информация о экологических аспектах этого соединения.
Характеристики продукта
| появление | Белый порошок |
|---|---|
| чистота | Min 99.0 |
| кл(Cl) | Max 0.01 |
| сульфат (SO4) | Max 0.05 |
| фе (ppm) | Max 10 |
| пчас | 4.0-5.0 |
Введение и общая информация
Введение
«Этилендиаминтетрауксусная кислота динатриевая соль» представляет собой аминокарбоксильную кислоту, в которой два протона (H+) структуры из четырех протонов кислоты нейтрализуются натрием. Основная известность натриевых солей ЭДТА обусловлена их способностью образовывать стойкие комплексы с металлами. Более точно, несвязанные электронные пары атомов азота и кислорода структуры проявляют координационное взаимодействие с ионами металлов, что приводит к образованию металлических комплексов. Эта уникальная характеристика ЭДТА стала причиной его широкого использования в качестве стабилизатора, смягчителя воды и комплексообразователя в различных отраслях промышленности. Кроме того, металлические комплексы ЭДТА используются в пищевой и сельском хозяйственном производстве как обогащающий компонент для конкретных продуктов.
Внешние характеристики
С точки зрения внешнего вида, натриевые соли ЭДТА обычно представлены в виде белых кристаллических порошков. Натриевые соли ЭДТА растворимы в воде. Растворимость соединения в воде прямо зависит от количества атомов натрия в продукте.
Химическая структура и механизм действия
В целом ЭДТА представляется химической формулой C10H16N2O8. Когда два атома водорода аминокарбоксильной кислоты этилендиаминтетрауксусной кислоты замещаются натрием, образуется соответствующая соль – EDTA-Na. В промышленности ЭДТА чаще всего поставляется в виде нейтрализованных солей с двумя атомами натрия (EDTA-2Na) или четырьмя атомами натрия (EDTA-4Na).
EDTA включает в себя насыщенную углеводородную цепь, четыре карбоксилатные группы и две аминогруппы. Одной из уникальных особенностей этого соединения является значительная гибкость геометрии структуры. Более точно, этиленовая цепь (-CH2-CH2-), оформленная из сигма-связей, позволяет образовывать различные пространственные изомеры.
Геометрическая гибкость EDTA позволяет структуре адаптироваться к форме, подобной перьям птиц, вокруг металлических ионов и вступать в реакцию. Вращение структуры вокруг этиленовой цепи облегчает процесс захвата металлических ионов и образования металлических комплексов. Фактически, ЭДТА представляет собой 6-зубчатый комплекс, который может взаимодействовать с тяжелыми металлами через карбоксилатные группы и аминогруппы, образуя соответствующие металлические комплексы.
Конечная структура образованного металлического комплекса обычно является 8-гранью (октаэдр), где молекула металла находится в центре и окружена лигандами. Эта геометрическая структура обычно обладает высокой стабильностью, что делает использование этого соединения в приложениях, связанных с уменьшением жесткости, более предпочтительным.
Добавление натриевых групп к структуре EDTA увеличивает растворимость соединения в водной среде и в некоторой степени изменяет pH в сторону нейтральной зоны. Это увеличение растворимости облегчает движение молекулы в водной среде и в некотором смысле способствует гибкости структуры в водной среде.
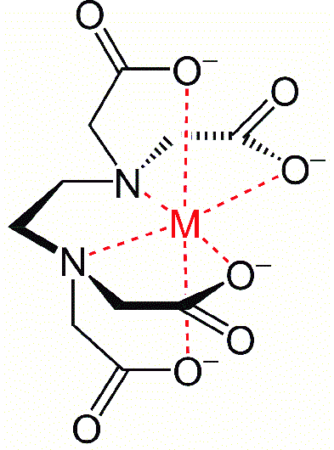
Конфигурация подобная «пятиперстной» (пентагональной) при формировании металлического комплекса с EDTA.
Различия между ЭДТА-2Na и ЭДТА-4Na
С точки зрения применения оба вида натриевой соли EDTA обладают одинаковой функциональностью в образовании хелатов с различными металлами. Основное различие между этими двумя видами соли заключается в пределах pH и их растворимости в воде. Как упоминалось ранее, EDTA обладает низкой растворимостью в воде. Добавление групп натрия в структуру этого соединения существенно увеличивает его растворимость в воде.
EDTA из-за своей кислотной природы является соединением, чувствительным к pH. Добавление групп натрия в его структуру уменьшает эту чувствительность к pH, так что EDTA-2Na менее чувствительна к изменениям pH по сравнению с чистым EDTA, а EDTA-4Na в целом проявляет лучшую работу в условиях близких к нейтральным pH
Соль EDTA-2Na имеет pH в диапазоне 4-5, в то время как pH соли EDTA-4Na может варьироваться от 10 до 12. Следовательно, EDTA-2Na проявляет лучшую работу в кислотных растворах, в то время как соль EDTA-4Na более совместима с нейтральными и щелочными растворами.
Возможные применения в различных отраслях
Текстильная промышленность
Применение EDTA при стирке текстильных изделий с водой, содержащей металлические ионы, помогает предотвратить осаждение этих соединений на поверхности ткани. Водород в воде также может вызвать реакцию с молекулами красителей, что приведет к изменению цвета ткани. Использование EDTA помогает устранить активные металлические ионы, снижает жесткость воды и улучшает процессы стирки, а также способствует более равномерному распределению красителей в процессе окрашивания.
Пищевая промышленность
Добавки на основе EDTA широко используются в пищевой промышленности. Различные исследования показывают, что железосодержащие келаты с EDTA лучше усваиваются в организме. В некоторых странах использование FeNaEDTA разрешено для обогащения пищевых продуктов.
Применение соединений на основе EDTA также помогает сохранять вкус и аромат продуктов питания и предотвращает нежелательные окислительные реакции. Например, “кальций динатрий эдтой” имеет широкое применение в пищевой промышленности как антиоксидант и добавка для придания вкуса.
Косметика, гигиенические средства, моющие средства
Одним из основных применений EDTA является его использование в моющих средствах, шампунях и средствах по уходу за кожей. В формулировке многих из этих продуктов широко используются различные поверхностно-активные вещества. Эти поверхностно-активные вещества, особенно анионные, подвержены реакции с металлическими катионами в воде. Такие реакции негативно сказываются на производительности поверхностно-активных веществ.
Использование EDTA в формулировке этих соединений помогает:
- Увеличить срок службы продукта и облегчить условия его хранения.
- Предотвратить негативное воздействие жесткости воды на функцию поверхностно-активных веществ.
- Предотвратить изменение цвета ткани при стирке.
Согласно описанию выше, ЭДТА широко используется в составе моющих, гигиенических и косметических продуктов.
Очистка газа от сероводорода
Соль железа EDTA – одно из соединений, которое помогает удалить сероводород из потока природного газа и последующе сделать газ более сладким. В ходе реакции дисульфида водорода с комплексом железа и EDTA железо с трехвалентного превращается в двухвалентное, а сероводород расщепляется на серу и водородный газ.
Медицина и фарма
Одним из применений натриевой или кальциевой соли этандиаминтетрауксусной кислоты (EDTA) является извлечение свинца или ртути из организма. Использование этого соединения для борьбы с отравлениями свинцом и ртутью является проверенным и широко используемым методом спасения пациентов, страдающих от опасных отравлений путем поглощения или впитывания тяжелых металлов.
С другой стороны, EDTA широко используется в анализе крови и как антикоагулянт. Катион кальция Ca2+ играет важную роль в процессе свертывания крови. Следовательно, образование металлического хелата и нейтрализация катиона кальция EDTA замедляют свертывание образцов крови, обеспечивая возможность проведения различных анализов и тестов.
Сельское хозяйство
Применение металлических хелатов, содержащих натрий, магний, медь, цинк и железо, в почву способствует улучшению плодородия и обогащению почвы. В последние годы использование удобрений, содержащих различные соли EDTA, имеет значительный рост. Одной из уникальных особенностей использования таких солей является непрерывное высвобождение металлических элементов. Эта особенность способствует оптимальному поглощению ионов металлов.
Нефть, газ, нефтехимия
Одной из распространенных проблем в процессе бурения является образование буровых отложений, особенно в слоях ближе к скважине. Эти отложения приводят к уменьшению производительности скважины из-за уменьшения дебита. Для решения этой проблемы предложены различные методы. Одним из наиболее эффективных методов преодоления этой проблемы является использование хелатообразующих соединений. Применение соединений, таких как EDTA, в сочетании с кислотным процессом приводит к образованию трещин и так называемых кислотных карманов в породе. Это особенно эффективно для углеводородов, находящихся в карбонатных породах, и приводит к значительному повышению добычи.
Помимо процесса стимуляции почвы, использование хелатообразующих соединений также приводит к поглощению металлических отложений. Согласно предыдущим пояснениям, EDTA, образуя хелат, помогает в поглощении ионов и, следовательно, осаждении металлических отложений.
Экологические аспекты
Как упоминалось ранее, с точки зрения здоровья, EDTA и соответствующие ему соли считаются безопасными и нетоксичными продуктами. FDA подтвердило использование этого продукта в косметической и гигиенической промышленности. Кроме того, во многих европейских странах использование металлических хелатов EDTA в качестве пищевых добавок также было одобрено. Тем не менее EDTA, особенно после образования металлических хелатов, не является биоразлагаемым соединением.
Следовательно, его нельзя отнести к категории экологически безопасных соединений.
Форма запроса специализированной информации
Нужна дополнительная информация об этом продукте?
Запросить дополнительную информацию
сертификаты

NACI

ISO 45001

ISO 14001

ISO 9001

isiri




